
更新时间:2022-03-14
近日,南方科技大学医学院教授肖国芝、副教授曹惠玲团队在国际学术期刊《自然·通讯》(Nature Communications)在线发表了题为“Kindlin-2 haploinsufficiency protects against fatty liver by targeting Foxo1 in mice”的长篇研究论文,首次揭示了粘附信号通路关键分子Kindlin-2蛋白在非酒精性脂肪肝(Non-alcoholic fatty liver disease,NAFLD)发生和发展过程中的重要作用。
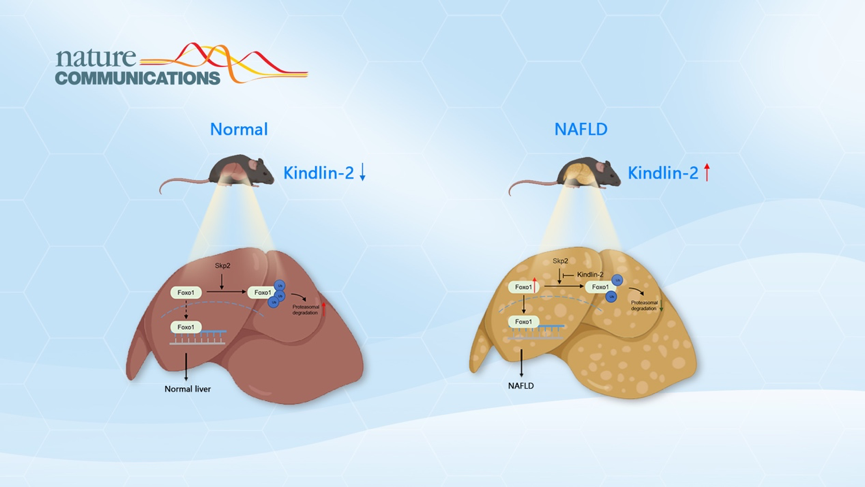
NAFLD是一种无过量饮酒史、以肝细胞脂肪变性和脂质堆积为主要特征的临床病理综合征,同时伴有高血脂,高血糖以及胰岛素抵抗等代谢综合征,是最常见的慢性肝病,在世界发病率达到三分之一,已成为当代社会人类健康的重大威胁。2018年数据显示中国NAFLD患病率达到32.9%,其中大概会有10-20%进一步发展成为NAFLD,随后进展为肝纤维化,并有较高风险发展成为肝硬化和肝癌等严重肝脏疾病。目前,NAFLD的发病机制尚不清楚,并且在全世界范围内尚无有效治疗NAFLD的临床用药。
本研究中研究人员首次发现,在NAFLD小鼠和病人的肝脏组织中,Kindlin-2蛋白的表达水平显著增高。在正常饮食状态下,Kindlin-2降低对小鼠代谢没有明显影响,但是Kindlin-2降低可以明显改善高脂饮食诱导的NAFLD。随后研究人员通过蛋白组学发现Kindlin-2和Foxo1蛋白结合,分子生物学和生物化学分析结果发现,Kindlin-2的C端区域可以与Foxo1结合并抑制Skp2介导的Foxo1蛋白的泛素化,增强了Foxo1的蛋白稳定性。此外,利用AAV8介导肝脏Kindlin-2敲低可有效减轻小鼠NAFLD。该研究首次发现了Kindlin-2在肝脏脂质代谢中的重要生理功能和调控机制,揭示Kindlin-2在NAFLD发病进展过程中的重要作用,为NAFLD的治疗提供了新的潜在治疗靶点。
课题组过去几年在研究Kindlin-2调节器官形成和稳态中取得了一系列的原创性科研成果。研究人员于2015年首次证明了Kindlin-2蛋白调节间充质细胞分化和骨骼发育的重要作用和新的分子机制(Wu et al, Nature Communications, 2015);2020年阐述了Kindlin-2在促进胰岛b细胞增殖和调节b细胞分泌胰岛素的作用和机制(Zhu et al, Nature Communications, 2020)及骨细胞Kindlin-2调节骨量、骨密度和骨重塑的重要作用(Cao et al, Bone Research, 2020; Fu et al, Signal Transduction Targeted Therapy, 2020);发现了Kindlin-2在椎间盘退行性变(intervertebral disc degeneration,IVDD)患者椎间盘髓核细胞中的表达水平显著下降, 小鼠髓核细胞缺失Kindlin-2导致严重的自发性IVDD表型,并加重有异常机械应力所致的IVDD损伤,Kindlin-2抑制髓核细胞中NLRP3炎症小体通路的激活从而维持髓核和椎间盘的稳态(Chen et al, Bone Research, 2022)。课题组最近发现,Kindlin-2在关节软骨细胞高表达,其下调导致骨关节炎,相关分子机制与Runx2-Stat3通路上调有关(Wu et al, Nature Aging, 2022)。
南方科技大学医学院研究助理教授高焕庆、深圳大学研究助理周良(现为中山大学博士研究生)和南方科技大学医学院硕士研究生钟一鸣、丁镇为共同第一作者,肖国芝和曹惠玲为共同通讯作者。南科大是论文第一单位。该研究工作得到了国家自然科学基金、国家科技部基金及深圳市科创委基金的大力支持。
论文链接:https://www.nature.com/articles/s41467-022-28692-z
供稿:医学院 高焕庆
主图:丘妍
编辑:朱增光